Разделы статьи:
Историческая справка
В 1963 году норвежский генетик Каре Берг описал необычную особенность уже известных к тому времени частиц ЛПНП (LDL — того самого «плохого холестерина»). Дело в том, что некоторая их часть имела на поверхности дополнительную антигенную структуру. Он решил, что это просто наследуемый признак и дал этому дополнительному компоненту скромное название — Lp(a): «Lp» как lipoprotein, а «(a)» — по традиции обозначения антигенов буквами. Сам Берг рассматривал Lp(a), как резус-фактор крови – просто некое дополнительное «качество» ЛПНП. Тогда никто и представить не мог, что это не просто «косметическая» особенность, а один из самых опасных игроков в нашей кровеносной системе.
Дальнейшее изучение таких ЛПНП Lp(a)+ показало интересные подробности этих частиц: липидное ядро действительно ЛПНП подобное, более того оболочка несет все тот же apoB белок. Но у них был яркий отличительный признак — к оболочке этой частицы намертво приклеен второй белок — apo(а), который отсутствовал у других липопротеинов. Именно его приняли изначально за новую «антигенную» характеристику, которая в реальности превратила обычный ЛПНП в нечто совершенно иное. Так концепция антигенной «особенности» некоторых ЛПНП сдвинулась к открытию нового класса частиц, название которых исторически оставили по Каре Бергу: Lp(a) = липопротеины а-малое.
Представьте человека: 40 лет, не курит, бегает марафоны, а его анализы на «плохой холестерин» вызывают зависть у врачей. И вдруг — внезапный инфаркт. Медицина разводит руками, врачи произносят сакраментальное: «плохая наследственность». Шли годы и накапливались уж очень подозрительные данные: слишком часто новая частица Lp(a) маячила свидетелем инфаркта или инсульта. Сказать, что она точно связана с сердечно-сосудистыми событиями было сложно – инфаркты случались и без нее.
Динамика познания Lp(a)
Настоящий прорыв случился в 1987 году, когда ученые наконец «раздели» этот загадочный апобелок(а) на поверхности частицы и расшифровали его структуру. Оказалось, что Lp(a) — это генетическая мина замедленного действия, которую стандартный анализ крови просто не видит: мы определяем ЛПНП, а в его цифре уже спрятан Lp(a), который не реагирует на лечение статинами, питание, физическую нагрузку и независимо может натворить много бед. Так в чем проблема Lp(a)?
Выяснилось, что белковый «прицеп» в виде apo(a) делает частицу невероятно агрессивной. Lp(a) не просто забивает сосуды быстрее обычного и мешает растворению тромбов (об этом далее), но и обладает таким «липким» потенциалом, что покажи ей только кусочек Лизина (аминокислота, которая обнажается при малейшем повреждении) – отцепиться будет сложнее, чем от детворы в Египте, которым показали доллар …
Но «золотой век» в изучении Lp(a) наступил в 2009–2011 годах. Именно тогда произошел качественный перелом: из подозрительной частицы, которая просто часто была на месте сердечно-сосудистого события, Lp(a) официально превратился в главного виновника инфарктов и инсультов.
Сразу две масштабные работы в престижнейших журналах (2009, JAMA, Emerging Risk Factors Collaboration — 2009, NEJM, Clarke et al.) вынесли вердикт: высокий уровень Lp(a) в крови и поломки в гене LPA напрямую связаны с риском коронарной болезни/инсульта. Но окончательную точку в 2011 году поставила менделевская рандомизация. Для многих этот термин не очень понятен, поясню: представьте, что сама Природа провела грандиозный эксперимент: одни люди с рождения получают гены, держащие Lp(a) на минимуме, а другие — «выигрывают» в эту лотерею аномально высокие уровни. Выяснилось, что вторым не помогают ни правильное питание, ни отсутствие вредных привычек — их риск инфаркта остается высоким просто по праву рождения.
С этого момента Lp(a) перестал быть медицинским артефактом. Он перешел в категорию независимого фактора риска. Это тот самый невидимый враг, который во многих случаях объясняет трагедии «образцовых пациентов». Бывает так: человек соблюдает все предписания, бросил курить, довел уровень обычного «плохого» холестерина (ЛПНП) до идеала, а повторный инфаркт все равно случается. В таких случаях Lp(a) часто оказывается тем самым неучтенным ускорителем, который продолжал разрушать сосуды из тени. Именно поэтому знать свой уровень Lp(a) — это базовая необходимость для каждого, кто хочет понимать свои реальные риски в картине современной кардиологии.
Взгляд на происхождение

Разумен вопрос – а какого фига (предпочтем именно это выражение) Природа создала такую аномалию? Вообще-то все должно быть наоборот. Разумного объяснения нет, но есть интересные теории, правдивость которых очень вероятна. Нобелевский лауреат Лайнус Полинг и его коллега Матиас Рат выдвинули одну из них, изящную, хотя и дискутабельную: около 40 миллионов лет назад предки человека потеряли способность самостоятельно синтезировать витамин С. Без витамина С сосуды становятся хрупкими, а коллаген — рыхлым (развивалась цинга). По мнению Полинга, Lp(a) появился как «эволюционная заплатка». Поскольку он невероятно липкий и способствует свертыванию крови, Lp(a) заклеивал микротрещины в рыхлых сосудах древних приматов, не давая им погибнуть от внутренних кровотечений при дефиците витамина С. Те, у кого Lp(a) был высоким, просто выживали в периоды голода. Мы — потомки тех, кто успешно «заклеивал» свои сосуды этим липким белком.
Долгое время считалось, что Lp(a) — эксклюзив человека и высших приматов. Но ученые обнаружили его у… обыкновенного ежа. Нестыковочка, однако. Теория Полинга тут терпит крах, но только с точки зрения эксклюзивной принадлежности приматам. Есть еще одна неочевидная подробность — Lp(a) умеет связывать и обезвреживать бактериальные токсины (например, стафилококковый токсин). В эпоху до антибиотиков любая рана могла стать смертельной. Lp(a) работал на два фронта: он помогал крови быстрее свернуться (закрыть ворота инфекции) и одновременно связывал яды, которые выделяли бактерии. Вообще-то это очень важно: высокий Lp(a) был билетом в жизнь для первобытного охотника, постоянно получавшего травмы.
В биологии есть термин «антагонистическая плейотропия» — это когда один и тот же ген полезен в молодости, но убивает в старости. Тебе нужно дожить до 20-30 лет, чтобы оставить потомство. Lp(a) помогает не умереть от раны или инфекции. Сейчас мы живем до 80 и более лет. Мы не умираем от хищников в 15 лет, зато наши сосуды десятилетиями «бомбардируются» этим липким белком. То, что спасало нас в каменном веке, убивает нас в эпоху офисов, так как «заплатки» начинают наслаиваться друг на друга, превращаясь в бляшки.
Так, все это интересно и даже отчасти правдоподобно, но нам бы понять суть: что там с биохимией этого apo(a), белка, который превращает обычный ЛПНП, который статин-диссиденты просто нежно целуют (он же субстрат клеточной стенки и гормонов!), в неясную разрушительную силу. И вот тут начинаются интересные подробности, некоторые из которых действительно могут иметь эволюционную подоплеку.
Структура липопротеина а-малое
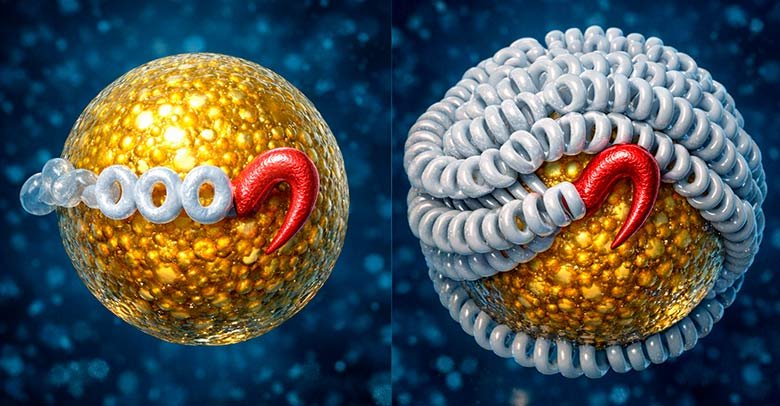
Прежде всего, этот apo(a) белок на поверхности Lp(a) намертво связан с другим белком всех атерогенных частиц — apoB дисульфидной связью. Это – важная деталь и вот почему. Типичный белок всех атерогенных частиц – apoB является структурным компонентом оболочки, фактически это скелет частицы, без нее просто не будет этой сущности. Он липофилен и вплетен в оболочку так, что не вырвешь его. А вот apo(a) – это совсем другое дело. Он любит воду (гидрофилен), окутан просто облаком сахарных цепочек (гликолизирован) и совершенно не стремится «занырнуть» в оболочку частицы. Дисульфидная связь – очень прочная, она не часто встречается в живых организмах, потому что это — фактически «мертвая сварка».
Представим ситуацию, что связи нет. Как только частица начинает движение в бурном потоке артериальной крови (а там давление и скорость приличные), аpo(a) просто «смывает» с поверхности, все … нет никакого Lp(a). Именно поэтому саму частицу чаще рисуют, как некую округлую структуру, за которой тянется хвост в виде apo(a), который намертво соединен с корпусом частицы через… эту самую дисульфидную связь. И мы дальше увидим, что в артериальном потоке с приличной скоростью, если apo(a) уцепится за лизин стенки сосуда, то вся кинетическая энергия летящей частицы ЛПНП c хвостом, который зацепился, придет на эту связь! И она выдерживает, останавливая этот липидный танкер около крючка-зацепки. Дисульфидный мостик — это единственное, что держит их вместе. Без него Lp(a) как патологической частицы просто не существовало бы — это были бы два независимых и гораздо менее опасных компонентов.
Более того, когда 2 белка «склеиваются», они меняют свою пространственную форму. Наша иммунная система (макрофаги) гораздо агрессивнее реагирует на этот «склеенный» конгломерат, чем на обычные частицы. Макрофаги видят в Lp(a) не просто переносчик жира, а «неправильный», «поломанный» объект и начинают пожирать его с утроенной силой, превращаясь в пенистые клетки — основу бляшки. Забегая чуть вперед скажу, что современные лекарства пытаются либо заблокировать создание apo(a), либо разорвать эту связь. Нет связи — нет проблемы.
А теперь конечно о датских кренделях… Если мы посмотрим на белок apo(а) под мощным микроскопом, мы не увидим привычной структуры. Перед нами предстанет странная нить, на которую плотно нанизаны одинаковые кольца. Первые исследователи, люди с долей юмора, заметили, что эти кольца напоминают традиционную датскую выпечку — крендели (кринглы). Так это название и закрепилось в науке: Kringles. Эти «биологические крендели» —функциональные модули, и каждый тип кольцевой структуры (уникальный тип Kringle) в цепочке белка отвечает за свое «злодейство». Я сейчас постараюсь максимально просто пояснить очень сложные биологические эффекты lp(a).
В составе apo(a) есть 10 видов кринглов 4 типа, обозначаются — KIV-1…10. И если слово «10 видов» нам понятно (например, 10 разных легковых машин), то что такое крингл 4 типа — … не совсем, кто вообще придумал эту «хрень» — крингл 4 типа? Ни сесть, ни встать… Но — поясню. Под кринглом понимается активный центр молекулы белка, который потенциально может с чем-то спариться для выполнения определенной функции, его называют красивым словом: активный домен молекулы ну или просто — модуль связывания. Так вот эти 10 видов кринглов нашего apo (a) ужасно напоминают 4-ый по счету с начала крингл … плазминогена! Вообще есть все основания полагать, что apo(a) эволюционно возник как плазминоген-подобный белок, где именно модуль, похожий на kringle-4, оказался самым удачным для многократного копирования.
Самый коварный в этой цепочке — крингл 4-го типа, номер 10 (KIV-10). У него есть уникальный «магнитный захват», настроенный на фибрин — основу наших тромбов. В чем здесь подвох? В нашей крови постоянно работает «бригада спасателей» — белок плазминоген. Когда образуется тромб, то он образуется всегда с избытком. Плазминоген цепляется за него своим 4-ым кринглом и растворяет его ненужную часть, оставляя целой лишь небольшую заплатку. Преграда кровотоку удалена.
Lp(a) — это гениальный мошенник. Его крингл KIV-10 почти идентичен 4-му кринглу спасателя-плазминогена (именно поэтому и называется Крингл 4 типа). Lp(a) подплывает к тромбу и первым занимает «парковочное место». Но есть критическое различие: у спасателя есть «инструменты», чтобы растворить тромб, а у Lp(a) их нет. Получается, что Lp(a) — это «собака на сене». Сам тромб не растворяет и другим не дает. Именно так Lp(a) потенциально может провоцировать инфаркты и инсульты.
Но есть одно «но» — теоретически, Lp(a) должен блокировать растворение тромбов, конкурируя с плазминогеном. Но на практике наш организм имеет мощные дублирующие системы лизиса. Кроме того, концентрация плазминогена в крови 1,5-2 мкмоль/л, что в 10 раз выше даже высоких концентраций Lp(a), — это сдвигает выигрыш в пользу команды спасателей. В современной кардиологии имеют в виду этот сценарий только для людей с экстремально высокими цифрами Lp(a). Гораздо бОльшее внимание приковано к другому факту.
По факту «спаривания» с фибрином, KIV-10 ищет Лизин (аминокислоту) для связывания. Лизин — это не только часть тромба. Это аминокислота, которая в избытке находится в белках сосудистой стенки (коллагене и эластине). Как только стенка сосуда чуть-чуть повреждается (от высокого давления или курения), Лизин «оголяется». Lp(a) пролетает мимо, цепляется своим KIV-10 за этот Лизин и встает на якорь.
Эволюционные детали

Вот тут я внесу определенную интригу, вспомню теорию Полинга/эволюционного характера Lp(a) и покажу как они красиво уживаются/дополняют друг друга. Представьте крингл KIV-10 не как плоское кольцо, а как сложную 3D-деталь, у которой есть разные «активные зоны». Сайт связывания Лизина (LBS — Lysine Binding Site) — это глубокая «расщелина» или «карман» в структуре крингла. Его форма и электрический заряд идеально подходят для того, чтобы туда вошла молекула Лизина. Это и есть наш «магнитный крюк». Буквально в нескольких ангстремах (мизерное расстояние) от этого кармана находятся некоторые специфические аминокислоты, главная из которых — Гистидин-33. Это специализированный захватчик окисленных фосфолипидов (OxPL). И не простой связью, а ковалентной – OxPL просто привариваются к этой точке.
Вот мы и подошли к апофеозной сути частиц Lp(a): оказывается, что это главный (80-90%) сборщик мусора в виде окисленных фосфолипидов (OxPL). Кстати, остальные 10-20% ловит ЛПВП (HDL — «хороший» холестерин). В нашей крови постоянно образуются эти опасные молекулы. Это обломки клеточных мембран, поврежденные свободными радикалами. Они токсичны: если они будут просто плавать в крови, они начнут «разъедать» эндотелий повсеместно. Но в крингле KIV-10 есть специфический карман. Он химически «заточен» под то, чтобы ловить именно деформированные, окисленные головки липидов. А окисленные фосфолипиды «обожают» именно KIV-10. Lp(a) работает как высокотехнологичный пылесос для токсичных отходов!
Хорошо – но почему центр Лизина и «пылесос» OxPL расположены рядом??? И при чем тут Полинг? Представьте первобытные времена. Раны, инфекции, укусы. Когда ткань повреждается, там мгновенно образуется огромное количество окисленных фосфолипидов (OxPL). Это «химический крик боли» клеток. Эти OxPL очень агрессивны: они вызывают неконтролируемое воспаление. И тут появляется Lp(a): он летит на место раны, ориентируясь на «запах» лизина (обнаженного коллагена), прилипает там. И тут же начинает пылесосить вокруг себя все OxPL (функция мусорщика), чтобы воспаление оставалось локальным и не убило весь организм. То есть Lp(a) — это не просто «пластырь», это «пластырь с антисептиком и детокс-эффектом».
Лайнус Полинг, указывая на потерю способности синтезировать витамин С, говорил как раз о OxPL. И это действительно так – у нас всех есть неработающий ген, который должен производить фермент L-gulonolactone oxidase – ген GULO. Миллионов 25-40 назад ген работал и человек мог синтезировать витамин С из глюкозы, но ген… отключился. Теперь витамин С должен поступать только с пищей. Но именно витамин С обладает сильнейшими антиоксидантными свойствами! Дефицит витамина С = колоссальный окислительный стресс. В крови стало плавать огромное количество OxPL (мусора). Природе понадобился специализированный инструмент, который бы этот мусор собирал и «запирал» на себе, чтобы он не сжег сосуды. Lp(a) стал этим инструментом. Он взял на себя работу, с которой не справлялись другие системы в условиях дефицита антиоксидантов. Ну ведь красивая теория…
Где произошел «баг» в системе? Проблема в том, что эволюция создала Lp(a) для краткосрочных операций. Раньше: прилетел к ране -> собрал мусор -> рана зажила -> Lp(a) утилизировался. Сейчас: у нас нет открытых ран, но есть «хронические раны» внутри сосудов от нашего образа жизни — курение, сахар, давление, не двигаемся. Lp(a) летит туда (и получается, что летит куда надо!), собирает мусор из крови… но рана не заживает. Он годами копится в одном и том же месте, превращаясь из мусоровоза-спасателя в свалку токсичных отходов прямо в «центре города». Когда копятся обычные ЛПНП, то многие риски относительные, ведь это, грубо, обычная капля жира. Но зацепившийся Lp(a) – это контейнер с отходами в виде окисленных фосфолипидов (OxPL). Это самые агрессивные молекулы в нашем организме. Для иммунной системы эти окисленные фосфолипиды выглядят, как бактериальный яд. Макрофаги сходят с ума, начинают «пожирать» всё вокруг и вызывают мощнейшее воспаление. Именно поэтому бляшки у людей с высоким Lp(a) такие нестабильные: они похожи на вулкан, который готов извергнуться в любую секунду… А курение при высоких цифрах Lp(a) – это не опасно, это — … суицидально.
Лабораторные нормы и диагностика уровней Lp(a)
Теперь давайте все же перейдем к цифрам уровня Lp(a) в крови человека и взглянем на эти концентрации с позиции ноу-хау. Во-первых, Lp(a) – генетически детерминированная частица, это означает, что ее уровень в крови человека почти не изменяется, не зависит от каких-то факторов здорового образа жизни и полностью формируется к 5-6 годам, далее этот уровень Lp(a) будет у человека всю жизнь. Во-вторых, Lp(a) у разных людей разные. Да, вы сейчас уже понимаете, что «разное» может быть только в том самом apo(a) белке, но что?
Мы только что вели длинную беседу о Крингле KIV-10. И он 1 (один) в белке. А вот «разность» apo(a) заключается в количестве повторов Крингла KIV-2 (Крингл 4 типа номер 2). Это основной структурный крингл этого белка в виде все того же колечка. И идентичных повторов KIV-2 может быть от единиц до … нескольких десятков. И количество этих повторов определяет генетика, они не меняются со временем: если у человека 5 повторов KIV-2, у него до смерти apo(a) будет иметь 5 повторов, а не 2 или 40.
Lp(a) с коротким apo(a) белком (2-5 повторов KIV-2) подобен юрким мотоциклам, они заедут в любой закоулок. И что главное – 2-5 повторов печень штампует очень быстро, это «легкая» сборка. А вот длинный «брат» с 20-40 повторами – это тяжелая фура, абы куда не заедет и маленькую трещинку сосуда проигнорирует. Более того, apo(a) белок перед выпуском в кровь гликолизируется – вокруг него формируется облако сахаров, если структура длинная, то сам белок получается вязким и неповоротливым. Это резко снижает скорость производства. Именно поэтому «короткие» гены —путевка в группу высокого риска: Lp(a) в крови становится слишком много, и он становится слишком пронырливым. А вот с «длинными» генами все намного спокойнее.
А теперь самое интересное. Вопрос: какой Lp(a) больше весит – как юркий мотоцикл или огромная фура? Ну конечно огромная фура. Посмотрите на свой анализ Lp(a) – он в мг/дл? Вы идете в лабораторию и получаете результат, к примеру 90 мг/дл. Это почти в 2 раза выше верхнего предела в 50 мг/дл. Но эта цифра всего лишь говорит сколько по весу Lp(a) в объеме крови. А как вы проверите, что результат дал короткий или длинный вариант apo(a) белка? Да никак. А между тем – это критически важно для прогноза: короткие, в большом количестве (их просто туча в этом 1 дл крови) гораздо опаснее десятка неповоротливых длинных, а Lp(a) в мг/дл будет… один и тот же. Что делать? Конечно надо измерять в нмоль/л – этот результат даст количество частиц и объективизирует и цифру, и выводы по риску… ( 1 г/л = 100 мг/л, некоторые лаборатории дают концентрацию в г/л, сути это не меняет — это масса частиц в объеме, которая ни слова не говорит об их количестве)
Вообще, этот лабораторный анализ в мг/дл прям детективная история… Чтобы измерить количество частиц правильно в нмоль/л, нужно иметь эталонный образец — чистый Lp(a), с которым лаборатория будет сравнивать вашу кровь. Из-за того, что у каждого человека Lp(a) разного размера («длинные» и «короткие» крендели), создать «универсальный эталон» невероятно сложно. Только недавно (в последние 10-15 лет) появились международные стандарты (WHO/IFCC), которые позволяют калибровать приборы именно в нмоль/л. Многие лаборатории просто не хотят тратиться на переоборудование и покупку дорогих новых реагентов.
Большинство обычных лабораторий используют дешевый метод — турбидиметрию. Они добавляют в кровь антитела, которые «прилипают» к Lp(a) и делают раствор мутным. Прибор измеряет степень мутности. В чем подвох: антитела обычно цепляются за те самые повторяющиеся крендели KIV-2. Если у вас длинный белок (много KIV-2), к нему прилипнет МНОГО антител. Раствор станет очень мутным. Прибор скажет: «Ого, какой высокий вес! (мг/дл)».
Если у вас короткий белок (мало KIV-2), к нему прилипнет МАЛО антител. Раствор будет почти прозрачным. Прибор скажет: «Всё в норме, вес низкий». Более того метод мг/дл систематически преувеличивает опасность длинных (менее вредных) белков и скрывает опасность коротких (самых агрессивных) белков. Справедливости ради, мг/дл не совсем бесполезны. Если анализ показывает 150-200 мг/дл, то как бы мы ни считали (в частицах или в граммах), это много. Ошибиться в 2-3 раза при таком высоком уровне уже не так страшно — печень просто не сможет наштамповать в таком количестве больших фур, там ТОЧНО будут мелкие и опасные разведчики с кладбища (извините, я так мотоциклистов называю). Риск всё равно будет большой. Тем не менее – это все равно «на пальцах», а хотелось бы точнее.
Кроме того, данные 40 лет клинических исследований проводились именно в мг/дл. Все врачи привыкли к цифре «30» или «50». Перейти на нмоль/л — значит заставить всех врачей переучиваться и запоминать новые нормы (например, 100-125 нмоль/л). Но это надо! Да, при 5 мг/дл или 150 мг/дл метод не важен. Но миллионы людей находятся посередине. И именно для них выбор единиц измерения — это вопрос того, пропустит врач их риск или нет. Современные клинические рекомендации (европейские и американские) уже официально говорят: измерять Lp(a) нужно только в нмоль/л. Если лаборатория этого не делает — она просто застряла в прошлом веке.
Пару слов о неизменной (генетической) концентрации Lp(a). Для длинных форм это справедливо. Печень просто не может наштамповать много тяжелых фур – это время и особенности производства. Поэтому фабрика производства в гепатоците работает примерно в одном режиме (колебания реально минимальные). Но вот когда печенка штампует короткие формы Lp(a) все же ген LPA свою активность контролирует. Там масса цепей обратной связи: и потребность организма в холестерине, и количество рецепторов LDL-R, и воспалительные процессы, и функция щитовидной железы, и другие гормональные влияния. Кстати, простой пример: женские эстрогены связываются со специальными участками ДНК и «придавливают» активность производства apo(a). В постменопаузе, заслонка открывается, производство apo(a) растет и концентрация Lp(a) может подняться на 20-30%! Добавляем ЗГТ – и липопротеин а-малое снова падает…
Статины, iPCSK9, Инклисиран и Lp(a)
А как статины действуют на Lp(a)? Есть несколько основополагающих работ, выводы которых неоднозначны. Что известно точно – статины не снижают уровень Lp(a). В лучшем случае они оставляют его таким же. Обновленные данные Европейского общества по изучению атеросклероза и Американского общества кардиологов осторожно формулируют: «Статины слегка повышают Lp(a) или не меняют его». Но большие мета-анализы более пессимистичны. Так, большой удар по мифу о нейтральности статинов нанес мета-анализ, опубликованный в European Heart Journal (2020) командой под руководством Sotirios Tsimikas:
- Ученые проанализировали данные более 5200 пациентов из шести рандомизированных контролируемых исследований.
- Вывод: статины (аторвастатин, розувастатин и др.) в среднем повышают уровень Lp(a) на 10–20% от исходного уровня. У некоторых пациентов этот рост был еще более выраженным.
- Исследование показало, что рост Lp(a) наблюдается почти у всех, но клинически значимым он становится у тех, у кого уровень уже был погранично высоким.
Множество других работ указывает на то, что рост Lp(a) характерен для людей с «короткой» генетикой apo(a) (2019, журнал Atherosclerosis — Yahya et al). Но каков механизм этого явления? Основная гипотеза (подтвержденная in vitro в работе Tsimikas) такова — статины блокируют синтез холестерина в печени. В ответ на это клетка активирует регуляторные элементы, которые должны повысить захват жиров. По «ошибке» или в рамках компенсации активируется промотор гена LPA, который открывает заслонку фабрики производства. И работа фабрики более вариабельна для быстрого синтеза = коротких форм apo(a) — тех самых, у которых мало кринглов KIV-2. У них уровень Lp(a) может подскочить на 30 мг/дл и выше.
Хорошо, но iPSK9 препараты (алирокумаб и эволокумаб) все же снижают Lp(a), а это – как? Дело в том, что они настолько мощно (в десятки раз) увеличивают количество рецепторов-ловушек (LDL-R) на поверхности печени, что даже «плохая рыба» в лице Lp(a) начинает ими ловиться (чего не происходит в нормальных условиях). Иными словами — когда их становится аномально много, они начинают высасывать из крови всё подряд, включая Lp(a). Это снижает его уровень на 15–30%. Точно таким же действием обладает Инклисиран, он другого механизма действия, но смысл один – препарат тоже аномально наращивает количество LDL-R рецепторов, что снижает Lp(a) на 15-25%.
Все эти явления порождают ряд вопросов. Первый — а надо ли вообще применять статины при высоких уровнях Lp(a)? Ведь фактически мы говорим о дальнейшем повышении его уровня и увеличения рисков. В этой связи есть ряд нюансов. Представьте, что вы идете по лесу, где только в выделенных местах (на высокой траве) будут сидеть иксодовые клещи. Да, они могут заразить вас болезнью Лайма или даже клещевым энцефалитом. Но их мало. Это – Lp(a) частицы в типичной концентрации 100 нмоль/л. Но в лесу полно мошкары, которая мешает вам ориентироваться и обходить потенциально неблагоприятные участки. Это ЛПНП, которых в ~40 раз больше, чем Lp(a). Более того, мы хорошо знаем, что уменьшая количество мошкары на 1 ммоль/л – повышаем на 22% шанс выйти из леса без укуса клеща. Будем снижать ЛПНП? Ответ очевиден – будем.
Именно такой консенсусный вывод всех медицинских сообществ, изучающих атеросклероз: пока нет препаратов, которые бы действовали точечно на Lp(a) надо снижать общие риски путем снижения ЛПНП. А это – статины, не взирая на то, что они могут даже несколько повысить уровень Lp(a). Например, Европейское общества по изучению атеросклероза (EAS) по Lp(a) отвечает на типичный вопрос «надо ли прекращать статин при росте Lp(a)?» — ответ нет, вместо этого усиливают контроль apoB/LDL-C и других факторов риска.
Таргетные Lp(a) препараты
Слушайте, но ведь уже у многих на устах специализированные препараты Пелакарсен (Pelacarsen) и Олпасиран (Olpasiran), ведь они-то снижают конкретно Lp(a)? А вот тут – целый триллер, развязку мы скоро узнаем, и пока он держит нас в напряжении.
Пелакарсен (Pelacarsen): это антисмысловой олигонуклеотид (ASO, не буду в механизм, не закончу статью вообще). Он связывается с матричной РНК и блокирует синтез апобелка(а). Если говорить о влиянии iPCSK9 или Инклисирана на Lp(a) по сравнеию с Пелакарсеном, то это косметический ремонт и снос здания. Пелакарсен снижает уровень Lp(a) на 80-90%! Идет масштабное исследование 3-й фазы HORIZON (около 8000 участников). Результаты ожидались/ожидаются в 2025–2026 годах. Это исследование ответит на главный вопрос: снижается ли количество инфарктов?
Олпасиран (Olpasiran): Это малая интерферирующая РНК (siRNA) — технология как у Инклисирана, но бьет точно в ген LPA. Этот препарат вообще впереди планеты всей: снижение Lp(a) до 95% и … более. Не просто здание снесли, а и фундамент новый залили. Исследование 2-й фазы (OCEAN(a)-DOSE) показало феноменальную эффективность. Сейчас запущена 3-я фаза — OCEAN(a)-Outcomes. Результаты ждем 2027-2028 годах.
Мувалаплин (Muvalaplin): чтобы вы знали — есть даже таблетка! Она не дает белку аpo(a) «свариться» (образовать дисульфидный мостик) с частицей ЛПНП. Снижает Lp(a) на 65-80%. Это продукт компании Eli Lilly, проходящий 2 фазу клинических испытаний. Перспективы огромные – все же таблетка, другой механизм с более низкой стоимостью производства.
Но у всей этой «затеи» по прямому снижению уровня Lp(a) есть краеугольный вопрос: а снизится ли при этом сердечно-сосудистые события? Казалось бы, если Менделевская рандомизация (генетика) говорит: «Низкий Lp(a) = долгая жизнь», то почему мы сомневаемся в успехе лекарств? Расчеты показывают, что Lp(a) — гораздо более «слабая» частица в плане веса риска, чем обычный ЛПНП. Чтобы получить такое же снижение риска, которое дает снижение ЛПНП на 1 ммоль/л, нам нужно обрушить Lp(a) на колоссальную величину — примерно на 150–200 нмоль/л (или 60-100 мг/дл). Если у человека уровень 150 нмоль/л и мы снизим его до 20, это скорее всего сработает. А если у него 80 нмоль/л и мы снизим до 10 — почувствует ли это сосуд? Возможно, этой «дельты» не хватит для статистического успеха в группе.
В истории кардиологии был «черный лебедь» — лекарства (ингибиторы CETP- торцетрапиб, далцетрапиб), которые феноменально повышали «хороший» холестерин и снижали «плохой». Все ждали триумфа, но… смертность не упала, а кое-где и выросла. Ученые с тех пор дуют на холодную воду. Они боятся, что Lp(a) может иметь какие-то скрытые полезные функции (например, регенерацию тканей), которые мы «выключим» вместе с риском инфаркта. Или не учтем какие-то off-label взаимодействия, как с торцетрапибом (рост АД).
Поэтому консенсусный вывод по Lp(a) сегодня простой: причинная роль Lp(a) поддержана, но единственный окончательный ответ даст только наблюдаемое снижение сосудистых событий из качественных, рандомизированных исследований. И результат мы получим совсем скоро. Но уже сейчас понятно одно: чем раньше мы узнаем свой уровень Lp(a), тем больше четкой информации по рискам для сосудов у нас будет. И сделать это надо 1 раз в жизни.
Фирменный почерк: аортальный стеноз
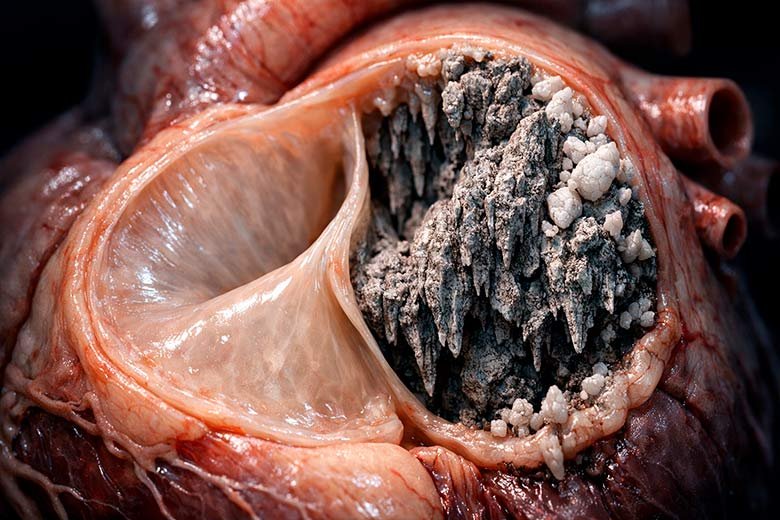
Публикуя информацию по Lp(a), я просто не имею права пройти мимо «фирменного почерка» именно липопротеина а-малое. Это стеноз аортального клапана (АК) сердца. Имея высокую концентрацию Lp(a), за АК надо пристально следить. Обычный плохой холестерин (ЛПНП) редко может сам по себе «убить» клапан, а вот Lp(a) делает это методично и непоправимо. Давайте разберем, почему.
Аортальный клапан находится на выходе из левого желудочка сердца. Это самое «стрессовое» место во всей системе кровообращения. Здесь максимальное давление, огромная турбулентность (кровь вылетает из сердца с бешеной скоростью), створки клапана открываются и хлопают 100 000 раз в сутки. Из-за такой колоссальной нагрузки на створках клапана постоянно возникают микротрещины. И мы уже знаем, что происходит дальше: в этих трещинах обнажается лизин. Для Lp(a) это идеальная посадочная площадка. Он слетается туда, как мухи на мед. В случае с сосудами Lp(a) просто строит бляшку. Но с клапаном он делает нечто иное — он запускает оссификацию (окостенение). При этом клетки клапана начинают думать, что они — клетки костей (остеобласты). Они начинают вырабатывать гидроксиапатит — тот самый материал, из которого состоят наши кости! (механизм могу пояснить, но он выходит за рамки статьи, для интересующихся: связка Lp(a)–autotaxin (ATX)–lysophosphatidic acid (LPA) — один из наиболее «убедительных» кальцифицирующих путей). Створки клапана пропитываются кальцием и становятся жесткими, буквально, как гранит. Они перестают нормально открываться. Это и есть стеноз. Сердцу приходится качать кровь сквозь узкую «замочную скважину» и… в конце концов это закончится операцией по замене клапана.
Реальные риски, связанные с Lp(a)
Ну и наконец: неужели все так плохо? Если Lp(a) повышен, то из статьи – … время жизни на исходе? Так, теперь — бочка оптимизма. Есть люди с экстремально повышенным уровнем Lp(a) – 300-480 нмоль/л и… живут до 90 лет в полном здравии. Вероятно у них сосуды защищены мощным слоем гликокалекса, вероятно у них KIV-10 домен менее активный для связывания с Лизином, или он переносит меньше окисленных фосфолипидов. Но что абсолютно точно: у них нормальные цифра артериального давления и нет сахарного диабета. Эти 2 фактора + курение делают Lp(a) просто супер активным, а этого допустить мы не можем. Lp(a) не работает в одиночку. Чтобы «мусоровоз» застрял и вывалил токсин под интиму, ему нужны помощники: высокое давление, воспаление от курения, сахара или высокий уровень обычного холестерина (ЛПНП). Контролируя эти показатели и опуская ЛПНП, мы практически нивелируем риск повышенного Lp(a). Не делая этого – мы играем в рулетку.
Но каковы ожидания этой рулетки. Давайте покопаемся в цифрах без демонизации. Сначала я приведу нормы, а потом разберу несколько важных работ (РКИ и мета-анализы) с разбором ситуации. Уверен, вы этого нигде не встретите.
Клинические значения Lp(a), современный консенсус.
- <75 нмоль/л (<30 mg/dL) — «скорее исключает» вклад Lp(a), как значимого усилителя риска
- 75–125 нмоль/л (30–50 mg/dL) — «серая зона», важен общий риск пациента
- ≥125 нмоль/л (≥50 mg/dL) — «скорее подтверждает» Lp(a), как усилитель риска.
Ключевой момент: нет никой границы, когда происходит скачок риска, Lp(a) дает непрерывный градиент, он понемногу усиливается при любом повышении. Чтобы в определенной степени «напугать» пациента приводят цифры Копенгагского исследования (Copenhagen City Heart Study — Kamstrup et al.) — при экстремально высоком Lp(a) (например, >120 mg/dL) в сравнении с очень низкими уровнями наблюдается 3–4-кратное увеличение риска инфаркта миокарда. Да, это так, но никто же не смотрит работы. В Копенгагском исследовании принимали участие женщины и мужчины, у которых базовый риск сосудистого события был для женщин 10-20%, а для мужчин … 19-35%! Все курили и имели повышенные цифры АД. Чуть не сказал – пили и вели разгульный образ жизни. Это очень высокрисковая подборка людей, где Lp(a) легко реализут все, на что способен!
Но даже в такой высокорисковой когорте отличия по инфарктам в диапазоне 5 мг/дл – 84 мг/дл были статистически незначимы. А вот выше пошел достоверный рост событий и для этого фенотипа людей он составил в предельных концентрациях Lp(a) 3-4 кратное увеличение по инфарктам. Поэтому, если вы курите и имеете повышенное давление + у вас Lp(a) выходит из серой зоны, то риски получить инфаркт становятся ощутимыми, а при уровне 120 мг/л и выше риск явно перевалит за 50%, т.е. бОльшая половина людей его точно получат. Это даже не русская рулетка с 1 патроном, а 3-4 патрона из 6 в револьвере…
Но давайте разберем среднестатистическую популяцию. Есть 2 прекрасных анализа: мета-анализ 24 когорт (Lp(a) Collaboration / ERFC) и огромный пласт информации из UK Biobank (≈460 тыс., медиана наблюдения 11,2 года). При этом если примерно пересчитать цифры исследований -… они окажутся очень близкими по количеству роста событий. Я сейчас озвучу сухие цифры из UK Biobank, а потом дам свою аппроксимацию, полностью основанную на данных этих всех исследований. Итак, UK Biobank:
- Градиент сердечно-сосудистых событий почти линейный и составляет HR = 1,11 на каждые 50 нмоль/л роста уровня Lp(a). Пример: у человека Lp(a) = 20 нмоль/л и абсолютный риск сосудистого события = 5% за 10 лет. Если у такого же человека Lp(a) = 70 нмоль/л, то его абсолютный риск составит 5,55%.
- Если взять прагматичный высокий уровень ≥150 нмоль/л (~70 mg/dL; перевод приблизительный, точного нет в природе), то в первичной профилактике: HR = 1,50. Это означает полуторакратное увеличение вероятности события. Пример: у вышеописанного человека с базовым риском 5% при уровне Lp(a) = 150 нмоль/л мы получим 7,5%, а это значит, что примерно +3 человека из 100 «заработают» событие за 10 лет.
Понятно одно – чем ниже уровень Lp(a), тем больше на него можно не обращать внимание, а чем выше – тем агрессивнее надо корректировать иные факторы риска, чтобы уменьшить базовый уровень. Ниже – моя аппроксимация из исследований:
- Lp(a) < 75 нмоль/л: это нейтральный показатель для первичной профилактики. Базовый риск пациент почти не меняется.
- Lp(a) = 75 -125 нмоль/л: небольшое усиление базового риска, часто + несколько % ОТНОСИТЕЛЬНОГО риска. К примеру, при базовом 5% риск составит 5,5-6%.
- Lp(a) = 125-150 нмоль/л: умеренное усиление базового риска, условно при базовом риске 8% общий риск составит 9-10%.
- Lp(a) > 150 нмоль/л: выраженное (полуторакратное) усиление базового риска: 6% → 9%; 10% → 15%.
- Lp(a) > 120 мг/дл (экстремум, я не ошибся в единицах: копенгагское исследование проводилось в мг/дл, очень условно это 260-340 нмоль/л и выше ): если пациент будет похож на когорту Копенгагена, то риск инфаркта миокарда в разы выше.




